Discussion théorique sur le test de stabilité des aérosols induit par la formule d'Arrhenius
Le processus nécessaire au lancement de nos produits aérosols est d'effectuer un test de stabilité, mais nous constaterons que même si le test de stabilité a réussi, il y aura toujours différents degrés de fuite de corrosion dans la production de masse, voire des problèmes de qualité des produits de masse.Alors, est-il toujours utile pour nous de faire des tests de stabilité ?
On parle généralement de 50 ℃ trois mois de test de stabilité équivaut à deux ans de cycle de test théorique à température ambiante, alors d'où vient la valeur théorique ?Une formule notable doit être mentionnée ici : la formule d'Arrhenius.L'équation d'Arrhenius est un terme chimique.Il s'agit d'une formule empirique de la relation entre la constante de vitesse d'une réaction chimique et la température.De nombreuses pratiques montrent que cette formule n'est pas seulement applicable à la réaction gazeuse, à la réaction en phase liquide et à la plupart des réactions catalytiques multiphasiques.
Écriture de formules (exponentielle)
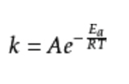
K est la constante de vitesse, R est la constante molaire des gaz, T est la température d'activation thermodynamique, Ea est l'énergie apparente et A est le facteur pré-exponentiel (également connu sous le nom de facteur de fréquence).
Il convient de noter que la formule empirique d'Arrhenius suppose que l'énergie d'activation Ea est considérée comme une constante indépendante de la température, ce qui est cohérent avec les résultats expérimentaux dans une certaine plage de température.Cependant, en raison d’une large plage de températures ou de réactions complexes, LNK et 1/T ne constituent pas une bonne ligne droite.Cela montre que l’énergie d’activation est liée à la température et que la formule empirique d’Arrhenius n’est pas applicable à certaines réactions complexes.
Pouvons-nous encore suivre la formule empirique d’Arrhenius dans les aérosols ?Selon les situations, la plupart d'entre elles sont suivies, à quelques exceptions près, à condition bien entendu que « l'énergie d'activation Ea » du produit aérosol soit une constante stable indépendante de la température.
Selon l’équation d’Arrhenius, ses facteurs d’influence chimique comprennent les aspects suivants :
(1) Pression : pour les réactions chimiques impliquant des gaz, lorsque les autres conditions restent inchangées (sauf le volume), augmenter la pression, c'est-à-dire que le volume diminue, la concentration des réactifs augmente, le nombre de molécules activées par unité de volume augmente, le nombre de les collisions efficaces par unité de temps augmentent et la vitesse de réaction s'accélère ;Sinon, cela diminue.Si le volume est constant, la vitesse de réaction reste constante sous pression (par ajout d'un gaz ne participant pas à la réaction chimique).Puisque la concentration ne change pas, le nombre de molécules actives par volume ne change pas.Mais à volume constant, si vous ajoutez les réactifs, encore une fois, vous appliquez une pression, et vous augmentez la concentration des réactifs, vous augmentez le taux.
(2) Température : tant que la température est augmentée, les molécules réactives gagnent de l'énergie, de sorte qu'une partie des molécules originales de faible énergie deviennent des molécules activées, augmentant le pourcentage de molécules activées, augmentant le nombre de collisions efficaces, de sorte que la réaction les taux augmentent (la raison principale).Bien entendu, en raison de l’augmentation de la température, la vitesse du mouvement moléculaire est accélérée et le nombre de collisions moléculaires de réactifs par unité de temps augmente, et la réaction sera accélérée en conséquence (cause secondaire).
(3) Catalyseur : l'utilisation d'un catalyseur positif peut réduire l'énergie requise pour la réaction, de sorte qu'un plus grand nombre de molécules réactives deviennent des molécules activées, améliorant considérablement le pourcentage de molécules réactives par unité de volume, augmentant ainsi le taux de réactifs des milliers de fois.Le catalyseur négatif est le contraire.
(4) Concentration : Lorsque les autres conditions sont les mêmes, l'augmentation de la concentration des réactifs augmente le nombre de molécules activées par unité de volume, augmentant ainsi la collision effective, la vitesse de réaction augmente, mais le pourcentage de molécules activées reste inchangé.
Les facteurs chimiques des quatre aspects ci-dessus peuvent bien expliquer notre classification des sites de corrosion (corrosion en phase gazeuse, corrosion en phase liquide et corrosion d'interface) :
1) Dans la corrosion en phase gazeuse, même si le volume reste inchangé, la pression augmente.À mesure que la température augmente, l’activation de l’air (oxygène), de l’eau et du propulseur augmente, ainsi que le nombre de collisions, ce qui intensifie la corrosion en phase gazeuse.Par conséquent, la sélection d’un inhibiteur de rouille en phase gazeuse à base d’eau approprié est très critique.
2) corrosion en phase liquide, en raison de l'activation d'une concentration accrue, certaines impuretés peuvent (telles que les ions hydrogène, etc.) dans un maillon faible et les matériaux d'emballage accélérer la corrosion produite par collision, de sorte que le choix de l'agent antirouille en phase liquide doit être soigneusement examiné combiné avec le pH et les matières premières.
3) Corrosion d'interface, combinée à la pression, à la catalyse d'activation, à l'air (oxygène), à l'eau, au propulseur, aux impuretés (telles que les ions hydrogène, etc.) réaction complète, entraînant une corrosion d'interface, la stabilité et la conception du système de formule sont très essentielles .

Pour revenir à la question précédente, pourquoi parfois le test de stabilité fonctionne, mais il y a quand même une anomalie lorsqu'il s'agit d'une production de masse ?Considérer ce qui suit:
1 : conception de stabilité du système de formule, telle que le changement de pH, la stabilité de l'émulsification, la stabilité de la saturation, etc.
2 : il existe des impuretés dans la matière première, telles que des changements dans les ions hydrogène et les ions chlorure
3 : stabilité des lots de matières premières, pH entre les lots de matières premières, taille de l’écart de contenu, etc.
4 : la stabilité des bombes aérosols, des valves et d’autres matériaux d’emballage, la stabilité de l’épaisseur de la couche d’étamage, le remplacement des matières premières provoqué par la hausse des prix des matières premières
5 : Analysez soigneusement chaque anomalie dans le test de stabilité, même s'il s'agit d'un petit changement, faites un jugement raisonnable par comparaison horizontale, amplification microscopique et d'autres méthodes (c'est la capacité qui manque le plus dans l'industrie nationale des aérosols à l'heure actuelle)
Par conséquent, la stabilité de la qualité des produits implique tous les aspects, et il est nécessaire de disposer d'un système qualité complet pour contrôler l'ensemble du port de la chaîne d'approvisionnement (y compris les normes d'approvisionnement, les normes de recherche et développement, les normes d'inspection, les normes de production, etc.) afin de répondre à la norme de qualité. stratégie, afin d’assurer la stabilité finale et la conformité de nos produits.
Malheureusement, ce que nous voulons partager à l'heure actuelle, c'est que les tests de stabilité ne peuvent pas garantir qu'il n'y aura pas de problèmes dans les tests de stabilité, et que la production de masse ne doit pas avoir de problèmes.En combinant les considérations ci-dessus et les tests de stabilité de chaque produit, nous pouvons prévenir la grande majorité des dangers cachés.Il nous reste encore quelques problèmes à explorer, à découvrir et à résoudre.L’un des attraits des aérosols est qu’ils permettent à davantage de personnes de résoudre davantage de mystères.
Heure de publication : 23 juin 2022





